Für einen aktuellen Überblick besuchen Sie die Seite Themenschwerpunkt Corona-Impfstoff. Eine Zusammenstellung der wichtigsten Fragen und Antworten (FAQ) rund um die COVID-Impfung finden sich unter FAQ Covid-Impfung (aekwien.at). Eine laufend aktualisierte Übersicht über den aktuellen Entwicklungsstand der Impfstoff-Kandidaten von dem Verband Forschender Arzneimittelhersteller finden Sie hier.
Großbritannien als Vorreiter im Westen
Großbritannien hatte Ende Dezember als erstes Land weltweit grünes Licht für den Impfstoff, den Astrazeneca mit der Universität Oxford entwickelt hat, gegeben. Für die EU und Österreich soll der ChAdOx1 nCoV-19-Impfstoff mit 400 Millionen vorbestellten Dosen das Rückgrat für die Durchimpfung der breiten Bevölkerung darstellen. Das wird auch dadurch erleichtert, dass die Vakzine bei normaler Kühlschranktemperatur von zwei bis acht Grad Celsius länger aufbewahrt werden kann.
Für das Produkt spricht auch, dass die Preise für die neuartigen mRNA-Impfstoffe von Biontech/Pfizer und Moderna wahrscheinlich um ein Vielfaches höher als die von herkömmlichen Mitteln wie jenem von Astrazeneca liegen. Die belgische Staatssekretärin Eva De Bleeker veröffentlichte die bisher geheim gehaltenen Preise zeitweise auf Twitter. Demnach soll eine Dosis des Moderna-Impfstoffs umgerechnet rund 15 Euro kosten, eine von Biontech/Pfizer zwölf Euro, eine von Astrazeneca nur 1,78 Euro. Der Tweet wurde später gelöscht.
Schutzrate könnte wesentlich geringer als jene der mRNA-Impfstoffe
EU-weit sind von Biontech/Pfizer sind für dieses Jahr 300 Millionen Dosen bestellt. Moderna will 2021 etwa 600 Millionen Impfdosen produzieren, die EU hat sich derzeit davon 160 Millionen gesichert. Vom Impfstoff von Astrazeneca wurden vorerst 400 Millionen Dosen bestellt. Österreich stehen vertraglich jeweils in etwa zwei Prozent Anteil dieser Mengen zu.
Vor drei Tagen ist die Phase II/III-Studie zum Vakzin als Zwischenauswertung (Lancet; 9. Jänner) nun als Printversion erschienen erschienen. Wichtig: Die Schutzrate könnte mit höchstens 70 Prozent wesentlich geringer als jene der mRNA-Impfstoffe mit jeweils mehr als 90 Prozent) sein.
Hier Daten mit Vergleichszahlen zu den drei Vakzinen. Für die Zwischenauswertung der ChAdOx1 nCoV-19-Vakzine wurden die Daten von erst 11.636 Probanden (Großbritannien, Brasilien) analysiert (insgesamt aufgenommen worden waren 23.848 Probanden). In der Wirksamkeitsstudie von Pfizer-Biontech (mRNA-Impfstoff/BNT162b) waren die Daten von 43.548 Probanden untersucht worden, in jener von Moderna (mRNA-Impfstoff/mRNA-1273) die Daten von 30.420 Probanden. Bei den mRNA-Impfstoffen bekamen die Kontrollgruppen ein Placebo, bei ChAdOx1 nCoV-19 hingegen eine vor Meningitis schützende Vakzine.
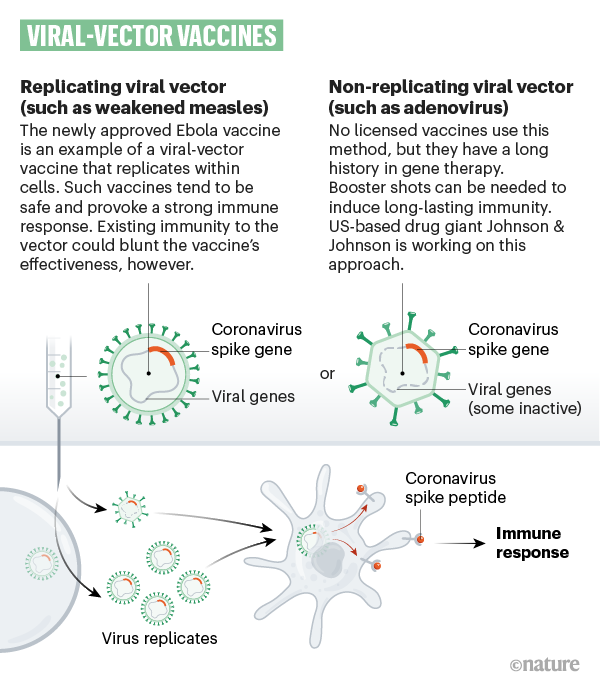
Der Vektor des Impfstoffs der Oxford Vakzine-Studiengruppe ist ein Adenovirus, das normalerweise Schimpansen infiziert. Durch die Entfernung von Genabschnitten verlor das Virus seine Fähigkeit, sich im Körper zu vermehren. Es ist allerdings noch in der Lage, Zellen zu infizieren und dort Gene abzulegen, aus denen dann Virusproteine hergestellt werden. In diesem Fall ist es das Gen (DNA) für das S-Protein (Spike-Protein) von SARS-CoV-2, gegen das eine Immunantwort in Gang kommen soll. Im Gegensatz dazu bestehen die mRNA-Impfstoffe (Pfizer-Biontech, Moderna) aus in Lipid-Nanopartikeln verpackte RNA-Bauanleitungen für die Produktion des S-Proteins in Zellen.
Schnelles Handeln in China
Auch wenn der erste im Westen zugelassene Corona-Impfstoff von dem deutschen Unternehmen Biontech entwickelt wurde, steht Deutschland im internationalen Vergleich bei den Impfungen nicht an der Spitze: Die Volksrepublik war im Sommer das erste Land weltweit, das gegen das neuartige Coronavirus impfte. Obwohl in China noch lange kein Corona-Vakzin zugelassen war, bekamen Risikogruppen wie etwa Beschäftigte im Gesundheitsbereich bereits Impfungen. Bis heute wurden knapp fünf Millionen Menschen in China geimpft - und an Silvester erteilten die Behörden erstmals eine bedingte Marktzulassung für ein Corona-Vakzin. Es handelt sich um den Impfstoff des chinesischen Pharmariesen Sinopharm.
Russland impft seit dem 5. Dezember Risikogruppen mit seinem selbst entwickelten Corona-Impfstoff Sputnik V. Dass die russischen Behörden Sputnik V im August schon vor Abschluss der letzten Testphase zugelassen hatten, war international auf Kritik gestoßen. Belarus und Argentinien begannen am 29. Dezember mit der Verabreichung des russischen Impfstoffs. Algerien plant dies für Januar.
Wie konnte die Impfstoffentwicklung derart beschleunigt werden?
15 bis 20 Jahre war bis vor wenigen Jahren die Zeitspanne, die man von der Virus-Analyse bis zur Zulassung eines Impfstoffs angesetzt hätte. Dabei muss jeder Impfstoff sechs Etappen durchlaufen. Dieser Prozess kann beschleunigt werden, wenn Impfstoffe dringend benötigt werden und Sicherheit und Wirksamkeit belegt werden können. Bereits vor der Corona-Pandemie haben Zulassungsbehörden ein neues Verfahren entwickelt, das diesen Prozess beschleunigen kann.
Wie läuft die Zulassung auf europäischer Ebene ab?
Die Europäische Arzneimittel-Agentur (EMA) mit Sitz in Amsterdam ist im zentralen europäischen Zulassungsverfahren von Covid-19-Impfstoffen als zentrale Prüfstelle zuständig. Nach einem Prüfverfahren gibt der Ausschuss für Humanarzneimittel (CHMP) eine Empfehlung über den Zulassungsantrag ab. Diese bildet die Basis für die endgültige Zulassungsentscheidung durch die EU-Kommission. Im „Rolling-Review“-Verfahren der EMA können Impfstoffhersteller, während die Phase-III-Studie noch läuft, kontinuierlich Daten einreichen und bewerten lassen, was zu einer vorläufigen Zulassung führen kann.
„Sollten dabei neue Nebenwirkungen oder andere Mängel festgestellt werden, kann die Zulassungsbehörde die Zulassung ändern oder auch zurückziehen“, erklärt Hartmut Hengel, Chef der Virologie der Uni Freiburg, kürzlich gegenüber dem deutschen Wissenschaftsmagazin „Spektrum“. Ein „Rolling-Review“-Prozess ist zeitlich auf maximal zwei Wochen beschränkt, es kann aber mehrere „Rolling-Reviews“ geben. Trotz Beschleunigung bleiben die Anforderungen an Qualität, Sicherheit und Wirksamkeit der betreffenden Arzneimittel nach Aussage der EMA unverändert hoch. Parallel zu dem kontinuierlichen Austausch mit Behörden bauen Impfstoffhersteller Produktionsstätten aus und kurbeln die Produktion an. Zuletzt haben das deutsche Unternehmen Biontech und der US-Pharmakonzerns Pfizer einen Antrag auf bedingte Marktzulassung für den Corona-Impfstoff BNT162b2 eingereicht, wie die EMA Ende November bestätigte.
Was ist eine bedingte Zulassung?
Die bedingte Zulassung („conditional approval“) ist für dringliche medizinische Bedürfnisse gedacht. Die EMA schreibt dazu: „Im Interesse der öffentlichen Gesundheit kann den Antragstellern eine bedingte Genehmigung für das Inverkehrbringen solcher Arzneimittel erteilt werden, wenn der Nutzen einer sofortigen Verfügbarkeit das Risiko, das von weniger als normalerweise erforderlichen Daten ausgeht, überwiegt.“ Die Zulassungsauflagen schreiben vor, dass fehlende Daten beispielsweise zur Langzeitwirksamkeit oder Daten in bestimmten Subgruppen so schnell wie möglich nach Zulassung nachgereicht werden müssen. Eine bedingte Zulassung gilt für ein Jahr und kann verlängert werden.
Welche Anforderungen werden an die Wirksamkeit eines Corona-Impfstoffs gestellt?
Die Vorteile eines Covid-19-Impfstoffs müssen nach EU-Arzneimittelgesetzgebung weitaus größer sein als alle Nebenwirkungen oder potenziellen Risiken. Der Ausschuss für Humanarzneimittel mit Wissenschaftern aus allen europäischen Zulassungsbehörden übernimmt die Beurteilung des neuen Mittels. Experten geben Einschätzungen zur Wirkung ab und äußern sich zu Unsicherheiten der Daten. Außerdem können sie dem Antragssteller weitere Fragen stellen. Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) bewertet die Arzneimittelsicherheit.
Die EMA besteht, wie die US-amerikanische Arzneimittelbehörde FDA, zu allererst darauf, dass Covid-19-Impfstoffe sicher sind und das in großen klinischen Studien auch überzeugend belegt wurde. Die FDA hat dabei eine Wirksamkeit von 50 Prozent als Mindestwert für eine mögliche Zulassung festgelegt. Das bedeutet, dass sich von einer größeren Gruppe von Geimpften höchstens halb so viele mit der Krankheit anstecken wie in einer vergleichbaren Gruppe von Ungeimpften. Die EMA hat sich diesbezüglich noch nicht festgelegt.
Angesichts kürzlich veröffentlichter Berichte zur Wirksamkeit des Corona-Impfstoffs BNT162b2 des deutschen Unternehmens Biontech und des US-Pharmakonzerns Pfizer zeigen sich Experten vorsichtig optimistisch. Der Umstand, dass diese Informationen bisher lediglich aus einer Presseaussendung stammen, stimmt aber auch viele Experten skeptisch. Eine umfassende Bewertung auf Basis der vorliegenden Informationen sei demnach schwierig. Man hoffe auf weitere Daten.
„Firma hat Recht auf ihre Daten, die sie selbst erhoben hat“
Doch während die Impfstoffhersteller den Zulassungsbehörden Daten vollständig zugänglich machen müssen, ist eine Veröffentlichung in Form einer wissenschaftlichen Publikation nicht verpflichtend. „Wir haben auch hier einen Konflikt: Die Firma hat ein Recht auf ihre Daten, die sie selbst erhoben hat, insofern ist ein Zwang zur Offenlegung problematisch“, ist Hartmut Hengel, der ärztliche Direktor des Instituts für Virologie an der Uniklinik Freiburg, überzeugt. „Auf der anderen Seite hat natürlich die Öffentlichkeit das Bedürfnis oder sogar den Anspruch, die Daten zu kennen. Auch die Ständige Impfkommission (Stiko), am deutschen Robert Koch-Institut (RKI), braucht publizierte Daten”, so Hengel gegenüber „Spektrum“.
Laut den publizierten Angaben liegt die Impfstoff-Wirksamkeitsrate des BNT162b2 Impfstoffs sieben Tage nach Verabreichung der zweiten Dosis bei über 90 Prozent. Demnach würde der Schutz schon 28 Tage nach Impfbeginn aufgebaut. Sollte sich der Trend in Richtung dieser hohen Wirksamkeit bestätigen, „wäre dies eine unerwartet hohe Impfeffizienz“, sagte der Impfstoff-Forscher Leif-Erik Sander von der Berliner Charité kürzlich zum deutschen Science Media Center (SMC). Viele routinemäßig eingesetzte Impfstoffe erreichten keine derart hohen Werte. „Dies ist umso erstaunlicher, als mit der mRNA-Technologie noch nie ein Impfstoff zugelassen wurde.“ Und auch wenn sich die Wirksamkeit in der Folge noch als etwas niedriger herausstellen könnte, glaubt der Direktor des Scripps Research Translational Institute in La Jolla (USA), Eric Topol, dass sie nicht unter 50 Prozent fallen werde, wie er in einem Beitrag im Fachmagazin „Nature“ erklärt.
Längerfristige Dauer des Impfschutzes wesentlich
Als „sehr ermutigend“ bezeichnet der Virologe Christian Drosten die veröffentlichten Daten. „Wenn jetzt die Studie weiterläuft, kann sich diese Zahl natürlich auch korrigieren, auch durchaus nach unten korrigieren. Damit muss man rechnen“, sagt Drosten in der Mitte November veröffentlichten Folge des „Coronavirus-Update“ bei NDR-Info. Aber prinzipiell habe der Impfstoff eine wirklich gute Schutzwirkung. Bei dieser Art von Impfstoffen, einer neuen Technik, habe man gar nicht gewusst, was man erwarten kann. „Das ist schon jetzt sehr ermutigend“, so der deutsche Virologe. Aber auch er betont, dass noch nicht mehr bekannt sei als eine Presseerklärung.
Der österreichische Virologe Florian Krammer von der Icahn School of Medicine at Mount Sinai in New York (USA), merkt an, dass es „selbstverständlich besser wäre, altersspezifische Daten zu sehen”. In dieselbe Kerbe schlägt auch Marylyn Addo vom Universitätsklinikum Hamburg-Eppendorf: „Derzeit gibt es noch wenige Details über die genauen Daten, zum Beispiel bezüglich verschiedener Altersgruppen.“
Ein wesentliches Kriterium sollte zudem sein, sich die Wirksamkeit des Impfstoffs über einen längeren Zeitraum anzusehen, wie Experten betonen. Zur längerfristigen Dauer des Impfschutzes könne man naturgemäß wenig sagen. „Für mich ist die Hauptfrage, was sechs Monate oder gar nur drei Monate später ist“, so Rafi Ahmed von der Emory University in Atlanta (USA).
Nachdem das US-Biotechnologieunternehmen Moderna kürzlich bekannt gegeben hatte, dass sein entwickelter Impfstoff eine Wirksamkeit von 94,5 Prozent besitzt, erklärte der führende US-Virologe Anthony Fauci in einem Interview mit der Nachrichtenagentur AFP, dass die Ergebnisse des US-Biotechnologieunternehmens eine nachdrückliche Bestätigung der experimentellen mRNA-Technologie seien, an der einige gezweifelt hätten. „Es gab viele Leute, die Vorbehalte hatten, etwas zu verwenden, das über die Jahre nicht erprobt worden war; einige Leute haben uns sogar dafür kritisiert“, sagt Fauci.
mRNA-Impfstoffe sind noch relativ neu. Wie beurteilen Experten die bisher verfügbaren Studiendaten?
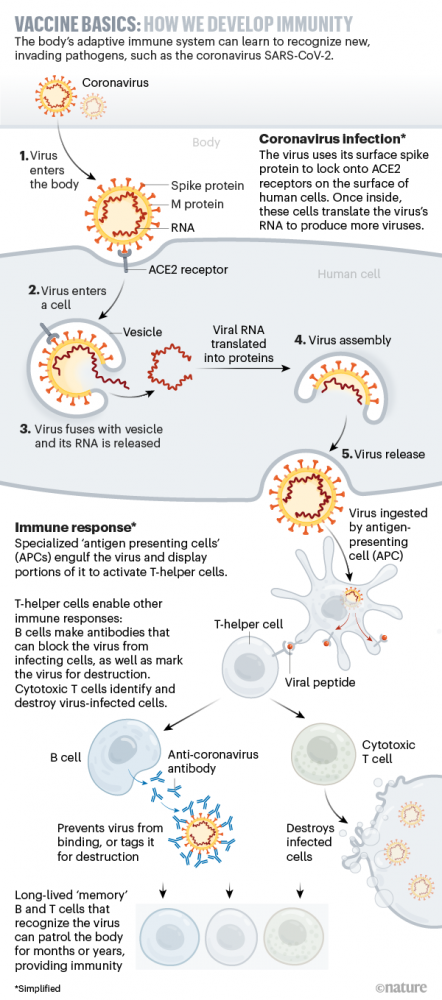
mRNA steht für messenger-Ribonukleinsäure, auch als Boten-RNA bezeichnet. Das Prinzip stammt aus der Krebsforschung, wo seit Jahren an personalisierten Impfstoffen gearbeitet wird. Während bei herkömmlichen Impfstoffen das Antigen selbst gespritzt wird, wird bei mRNA hingegen die genetische Information weitergegeben, so dass der Körper das Antigen selbst bildet.
Obwohl die mRNA-Impfstofftechnologie noch neu ist, gebe es bereits langfristige Erfahrungswerte mit dem grundsätzlichen Ansatz bei anderen Erregern. (siehe etwa „Nano Today“ 2019). „mRNA-Vakzine haben sich in den vergangenen Jahren als sehr vielversprechend erwiesen und viele davon sind in Entwicklung“, konstatiert Krammer vor wenigen Wochen in einem Überblicksartikel im Fachmagazin „Nature“. In Bezug auf den Impfstoff BNT162b2 sprach der Forscher kürzlich von einem „großen Durchbruch“.
Können mRNA-Impfstoffe ins menschliche Erbgut eindringen?
Laut Paul-Ehrlich-Institut besteht keine Gefahr, dass mRNA ins Genom eindringt. Die Erbinformationen des Menschen befinden sich in Form von DNA im Zellkern. Dass RNA dort eingebaut werden könnte, sei unter anderem wegen der unterschiedlichen chemischen Struktur nicht möglich. Es gebe auch keinen Hinweis darauf, dass die von den Körperzellen nach der Impfung aufgenommenen mRNA in DNA umgeschrieben werde. Die mRNA wird laut RKI nach kurzer Zeit von den Zellen abgebaut. Danach findet keine weitere Produktion des Antigens mehr statt. Auch das Bundesforschungsministerium verweist darauf, dass eine Impfung mit mRNA-Kandidaten begrenzt ist auf die Körper- beziehungsweise Muskelzellen um die Einstichstelle. Eine Veränderung des Erbguts, das heißt eine Beeinträchtigung der Keimzellen, könne nicht stattfinden.
„Die RNA ist ein Zwischenprodukt, welches für die Bildung von Proteinen genutzt wird“, erklärt UKE-Virologin Christine Dahlke kürzlich gegenüber „Focus”. Das menschliche Erbmaterial sei davon nicht betroffen: „Die Erbinformation besteht nicht aus RNA, sondern aus doppelsträngiger DNA, die sich im Zellkern befindet.“ Die RNA, so Dahlke, könne sich nicht in DNA umwandeln. Und: „Sie kann sich definitiv nicht in die DNA integrieren, weil sie gar nicht bis in den Zellkern vordringt.“
Wie bewerten Experten die Sicherheit der mRNA Impfstoffe?
Im Fall des Corona-Impfstoffs BNT162b2 deuten laut Firmenangaben verfügbaren Daten darauf hin, dass es harmlose Nebenwirkungen gibt. Es wurden „keine schwerwiegenden Sicherheitsbedenken angemeldet“, teilt das Unternehmen mit. Bisher gemeldet wurden lokal und zeitlich begrenzte Nebenwirkungen wie Rötungen an der Einstichstelle oder ein Unwohlsein für ein, zwei Tage. Ihre Reaktogenität sei also moderat. Wie geplant, würden weitere Daten gesammelt und mit den Regulierungsbehörden weltweit diskutiert, heißt es.
Der deutsche Impfstoff-Forscher Sander betont, dass sich aufgrund der Datenlage auch zu möglichen Nebenwirkungen noch nicht allzu viel sagen lasse. Er verwies kürzlich darauf, „dass der Beobachtungszeitraum für relevante Impfnebenwirkungen noch zu kurz ist“. Neben erwünschten Langzeitwirkungen zum Schutz vor Ansteckung müssten auch Langzeitnebenwirkungen langfristig auf dem Radarschirm bleiben. „Zumindest kurzfristig war dieses Vakzin sehr sicher“, erklärte der deutsche Infektiologe Clemens Wendtner. Gegenüber der APA sprach sich auch Heidemarie Holzmann von der MedUni Wien für eine „genaue Nachbeobachtung“ aus.
Spekulationen über Langzeitfolgen
„Impfstoffe müssen maximal sicher sein“, betont Hengel. „Wenn man eine Phase-III-Studie mit 10.000, 20.000 oder 30.000 Menschen macht, kann man nicht mit statistischer Sicherheit die Nebenwirkungen erkennen, die seltener sind”, sagt er gegenüber „Spektrum”. Die werde man erst sehen, wenn entsprechend mehr Menschen geimpft worden sind und eine gewisse Zeit verstrichen sei. Hengel verwies auf die Erfahrung mit dem Schweinegrippe-Impfstoff Pandemrix 2009: „Der Impfstoff galt zunächst als sicher und war zweifellos effektiv, doch dann erkrankten in wenigen Fällen junge Menschen nach der Impfung an Narkolepsie. Die Zulassung musste daher widerrufen werden”, so Hengel.
Im Zusammenhang mit möglichen Langzeitfolgen wird auch immer wieder das Phänomen die infektionsverstärkenden Antikörper („antibody dependent enhancement“, ADE) angeführt. Bei SARS- und MERS-CoV gibt es Hinweise darauf, dass unerwünschte ADE nach einer Impfung oder einer durchgemachten COVID-19-Erkrankung bei einer weiteren Infektion im ungünstigen Fall zu einer verstärkten Infektion führen könnten, schreibt das Paul-Ehrlich-Institut (PEI) im November auf seiner Webseite. „Bislang gibt es weder im Tiermodell einer SARS-CoV-2-Infektion noch bei COVID-19-Genesenen oder SARS-CoV-2-Infizierten Hinweise auf das Vorkommen einer ADE-verursachten Infektionsverstärkung.” Bei mRNA- und Vektor-Impfstoffkandidaten gegen andere Infektionskrankheiten sei ein ADE bisher nicht beobachtet worden, heißt es von Seiten des Instituts.
Können Corona-Impfstoffe dabei helfen, eine Herdenimmunität aufzubauen?
Eine Herdenimmunität bedeutet, dass ein großer Teil der Bevölkerung nach einer Infektion oder Impfung immun geworden ist und sich das Virus dadurch nicht mehr so leicht ausbreiten kann. Laut der Gesellschaft für Virologie (GfV) mit Sitz in Heidelberg GfV weiß man noch nicht zuverlässig, wie lange eine durch eine Infektion erworbene Immunität anhält. Eine Herdenimmunität durch eine Impfung kennen wir beispielsweise von den Impfungen gegen Infektionskrankheiten wie Polio oder Pocken.
Noch ist unklar, ob die Impfstoffe, die nun vor der Zulassung stehen, eine Übertragung des Erregers stoppen können. Der Leiter der klinischen Entwicklung bei Impfstoff-Entwickler Moderna, Tal Zaks, erklärte kürzlich, dass die Ergebnisse von Impfstoff-Studien nur zeigen, dass sie verhindern, dass Menschen krank werden. „Die Studien zeigen nicht, dass es verhindert werden kann, dass Sie dieses Virus möglicherweise vorübergehend in sich tragen und andere infizieren“, sagt Zaks kürzlich in einem Interview für „Axios“, einer Sendung von HBO, und fügte hinzu: „Wenn wir mit dem Einsatz dieses Impfstoffs beginnen, werden wir nicht über genügend konkrete Daten verfügen, um nachzuweisen, dass dieser Impfstoff die Übertragung reduziert.“
Infektionen der Atemwege mit Impfstoffen nur schwer vollständig zu blockieren
Experten warnen, dass die Idee einer Herdenimmunität durch Covid-19-Impfungen wenig erfolgversprechend sein könnte. Im Fachmagazin „The Lancet” (Sept 2020) schreiben zwei Ärzte und Professoren der Uni Hongkong, Malik Peiris und Gabriel M. Leung, dass die Impfung die Krankheit zwar abschwächen könnte, die Ansteckungsgefahr wohl aber nicht wesentlich reduzieren würde. „Eine einschränkende Wirkung der bisherigen COVID-19-Impfungen auf die Übertragung und Ansteckung mit Covid-Viren kann noch nicht beurteilt werden. Selbst wenn eine Impfung einen Schutz gegen die Erkrankung verleiht, bedeutet das nicht, dass sie im gleichen Maß auch die Übertragung oder Reproduktionszahl vermindert”, schreiben die Wissenschaftler.
Insbesondere Infektionen der Atemwege seien mit Impfstoffen schwer vollständig zu blockieren, sagte Bodo Plachter, stellvertretender Direktor des Instituts für Virologie am Lehrkrankenhaus der Universität Mainz kürzlich gegenüber der „Wiener Zeitung“. Impfungen würden wohl dazu beitragen, die Menge des zirkulierenden Virus zu reduzieren. „Es kann durchaus sein, dass die Geimpften weniger Viren ausscheiden, das bremst die Pandemie, es ist aber eine falsche Annahme, dass man die Pandemie allein aufgrund der Impfung wird verhindern können.“
Ähnlich sieht das auch Krammer: Aufgrund der Verabreichungsweise der Impfung (durch eine Injektion in den Oberarm) dürfte nur wenig lokaler Schutz der oberen Atemwege aufgebaut werden, weshalb es trotz Impfung zu asymptomatischen Infektionen kommen könnte, betont Krammer kürzlich gegenüber dem „Standard”. Zu dieser konkreten Frage gebe es aber noch keine Daten.
„Hätte man einen Impfstoff, der „transmissionsblockierend“ ist, dann könnten wir tatsächlich so weit gehen, dass wir beginnen, durch eine Impfung das zu erzielen, was wir als Herdenimmunität bezeichnen“, sagt der Virologe Herwig Kollaritsch kürzlich gegenüber dem „Standard”. Dafür brauche man aber ausreichend Impfstoff.
Was weiß man über die Immunantwort bei Reinfektionen?
Informationen zu Reinfektionen seien der Schlüssel zum Verständnis, welche Impfstoffe in der Lage sind, Einzel- bzw. Herdenimmunität zu erreichen, schreibt Immunologin Akiko Iwasaki von der Yale University, USA Mitte Oktober in einem Kommentar. „Je mehr Reinfektionsfälle bekannt werden, desto besser wird die wissenschaftliche Gemeinschaft verstehen können, wie der Schutz funktioniert und wie häufig natürliche Infektionen mit SARS-CoV-2 diesen Grad an Immunität bewirken.“
Da erst wenige Fälle von Reinfektionen sicher dokumentiert sind, gibt es über den Verlauf einer Reinfektion bisher keine Forschungsergebnisse. Forschende sprechen dann von einer Mutation. In einer kürzlich publizierten Fallstudie ( „The Lancet“ 2020) erklären Forscher dass sie weder in der Lage waren, eine Bewertung der Immunantwort auf die erste SARS-CoV-2-Infektion vorzunehmen noch die Wirksamkeit der Immunantworten (z.B. neutralisierende Antikörpertiter) während der zweiten Infektion vollständig beurteilen konnten.
Wie ist die Immunantwort bei Älteren/Immunsupprimierten?
Fraglich ist auch, wie gut Impfstoffe ältere Menschen schützen können, also die Hauptrisikogruppe. „Es muss sich auch noch zeigen, ob der Impfstoff auch in verschiedenen Bevölkerungsgruppen, insbesondere in Risikogruppen wie älteren Menschen, ebenso effektiv ist. Außerdem ist es enorm wichtig zu untersuchen, ob diese Impfung vor schweren Verläufen von COVID-19 schützt. Zudem muss sich zeigen, wie lange der Impfschutz anhält“, so der deutsche Impfstoff-Forscher Sander.
Der Virologe Krammer beschreibt in seinem Überblicksartikel („Nature“ 2020), dass ältere Menschen in Studien schlechter auf die Corona-Impfungen ansprächen. Dies ist auch bei anderen Impfungen der Fall: So schützt die Grippeimpfung ältere Menschen laut RKI nur zu etwa 50 Prozent. Die Corona-Impfungen müssten für einen besseren Schutz älterer Menschen womöglich noch weiterentwickelt werden, so Krammer. Nicht getestet wurden Impfungen bisher bei chronisch Kranken, die genau wie ältere Menschen zur Risikogruppe gehören. Wie gut welcher Impfstoff ist und in welcher Altersgruppe oder Risikogruppe, wird sich zeigen, wenn es mehr Phase-III-Daten zu verschiedenen Impfstoffen gibt.
Gibt es Forschung zur Kreuzimmunität von COVID19 mit anderen Coronaviren?
Eine Studie im Journal „Medical Hypothesis„ von Ahmed Yaqinuddin, der aus Pakistan stammt und jetzt an der Al-Faisal-Universität in Riad, Saudi-Arabien, studiert, ergründet dieses Thema. Er schreibt: „Von den sieben Coronaviren, die mit Krankheiten beim Menschen assoziiert sind, verursachen SARS-CoV, MERS-CoV und SARS-CoV-2 eine erhebliche Mortalität, teilen aber auch eine signifikante Gensequenzhomologie und potenziell antigene Epitope, die in der Lage sind, eine Immunantwort auszulösen.”
Der Grad der Ähnlichkeit sei so groß, dass möglicherweise eine vorherige Exposition gegenüber einem Virus eine partielle Immunität gegenüber einem anderen Virus verleihen könnte. Die Daten deuten auf eine beträchtliche Kreuzreaktivität und Erkennung durch die Immunantwort des Wirts zwischen verschiedenen Coronavirus-Infektionen hin. „Während der anhaltende COVID-19-Ausbruch die medizinischen Einrichtungen insbesondere in Europa und Nordamerika rasch überforderte und 78 Prozent der weltweiten Todesfälle verursachte, traten nur acht Prozent der Todesfälle in Asien auf, wo der Ausbruch seinen Ursprung hatte”, schreibt der Studienautor. Er stellt die Hypothese auf, dass ein ursächlicher Faktor, der einer so niedrigen Morbidität in diesen Regionen zugrunde liegt, möglicherweise auf eine erworbene Immunität gegen mehrere Coronavirus-Infektionsrunden zurückzuführen ist.
Wie werden Impfstoffe im europäischen Raum verteilt?
Europa hat Impfdosen von verschiedenen Herstellern reserviert. Die Verteilung an die Länder beruht auf einem Schlüssel gemäß Einwohnerzahl. Insgesamt hat Österreich mit bereits fünf der sieben Impfstoffanbieter fixe Vorkaufsverträge auf EU-Ebene abgeschlossen: AstraZeneca, SANOFI, Johnson&Johnson, BioNTech/Pfizer und CureVac. Mit den restlichen beiden Anbietern sind die Vorkaufsverträge auf EU-Ebene in Verhandlung, heißt es laut COVID-19 – Impfstrategie (November 2020).
Die EU-Kommission hat bereits Anfang November erklärt, dass man mit Biontech und Pfizer einen Vertrag zur Lieferung des vielversprechenden Impfstoffs ausgehandelt habe. Zur weltweiten Verteilung von Impfstoffen insgesamt und zu den sinnvollen Impfstrategien in den verschiedenen Ländern seien noch viele grundlegende Fragen offen. Da RNA-Vakzine wie BNT162b2 tiefgefroren gelagert werden müssen, stelle die Verteilung an sich schon ein gewisses Problem dar. Einer der beiden Impfstoffe, die gerade im „Rolling-Review“ sind, müsse etwa bei minus 80 Grad gelagert werden. Das erleichtere die Verteilung nicht, betonte der Infektiologe Kollaritsch Anfang November gegenüber dem „Standard“. Das stelle vor allem ein Problem in wirtschaftlich weniger entwickelten Ländern dar, in denen die Gewährleistung der Kühlkette eine besondere Herausforderung darstellt. Da die RNA-Technologie insgesamt neu ist, sei auch noch nicht klar, wie gut die Produktion großer Mengen an solchen Vakzinen funktioniert, schrieb Krammer in „Nature“.
Dann geht es an die komplexe Verteilung des Impfstoffes. „Das ist in etwa vergleichbar mit der Logistik für die Automobilindustrie“, sagt der deutsche Pharmalogistik-Experte Thomas Schnur vom Beratungsunternehmen Camelot MC. Nur, dass man diesmal in etwa sechs Monaten habe aufbauen müssen. Eine mögliche Engstelle sieht Schnur beim Luftverkehr: Wegen zurückgegangener Passagierflüge werde auch weniger Fracht, die darin zugeladen wird, transportiert. Logistikunternehmen bereiten sich aber darauf vor, etwa mit Frachtmaschinen die Verteilung von Impfstoffen zu gewährleisten. Ob es darüber hinaus zu Verzögerungen kommen kann, könne derzeit niemand beantworten, sagt das Paul-Ehrlich-Institut. Unterdessen haben die Hersteller angegeben, bereits seit Wochen und Monaten – auf eigenes Risiko – mit der Impfstoffproduktion begonnen zu haben, damit sofort nach der Zulassung mit der Auslieferung begonnen werden kann.
Was bedeuten die wissenschaftlichen Fortschritte für die Entwicklung von Impfstoffen für andere Krankheiten in naher Zukunft?
Der US-Chemiker Steven Fowkes warnt davor, allzu große Erwartungen zu hegen. „Viele der neuartigen Ansätze zur Impfung gegen SARS-CoV-2 beruhen auf seiner genetischen Stabilität, die sich unter Umständen nicht auf andere Viren übertragen lässt, die auf genetische Mobilität angewiesen sind. Die Influenzaviren zum Beispiel ändern sich von Jahr zu Jahr, so dass der Impfstoff in ein Jahr für die Grippe wirksam, in einem anderen Jahr grob unwirksam sein kann“, beschreibt er Mitte November gegenüber „medinlive“.
Der kanadische Molekularbiologe Ed Taboada sieht besonders in den mRNA-Plattformen großes Potenzial. „Sie sind enorm vielversprechend, weil man extrem schnell vom Erreger zum Probe Impfstoff übergehen kann. Ein neuer Erreger kann zur Herstellung eines neuen Probe Impfstoffs verwendet werden, indem man einfach die neue mRNA-Zielsequenz synthetisiert“, so Taboada Mitte November. „Die Tatsache, dass es jetzt zwei potentielle mRNA-Impfstoffe in anscheinend erfolgreichen Phase-III-Studien gibt deutet darauf hin, dass die Plattform für die Prime-Time bereit ist und dass sie einige der ursprünglichen Probleme gelöst haben, die den Fortschritt in den letzten zehn Jahren blockiert hatten“
Welche Impfstofftechnologien werden gegen das Covid-19-Virus eingesetzt?
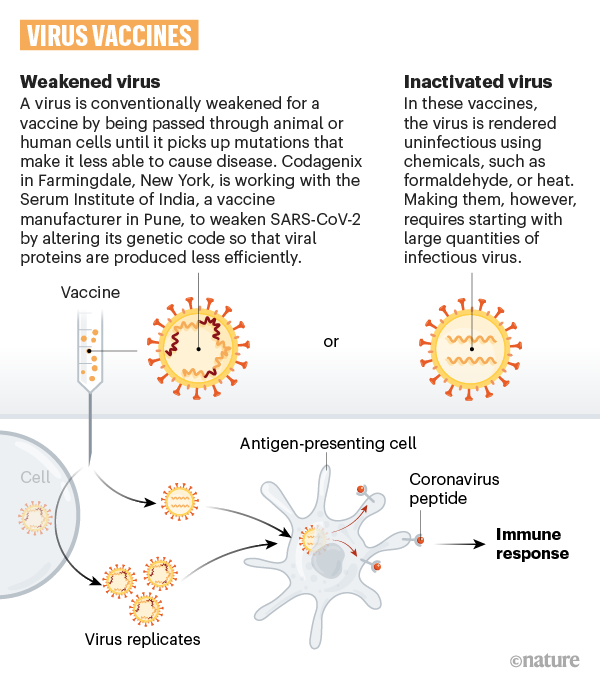
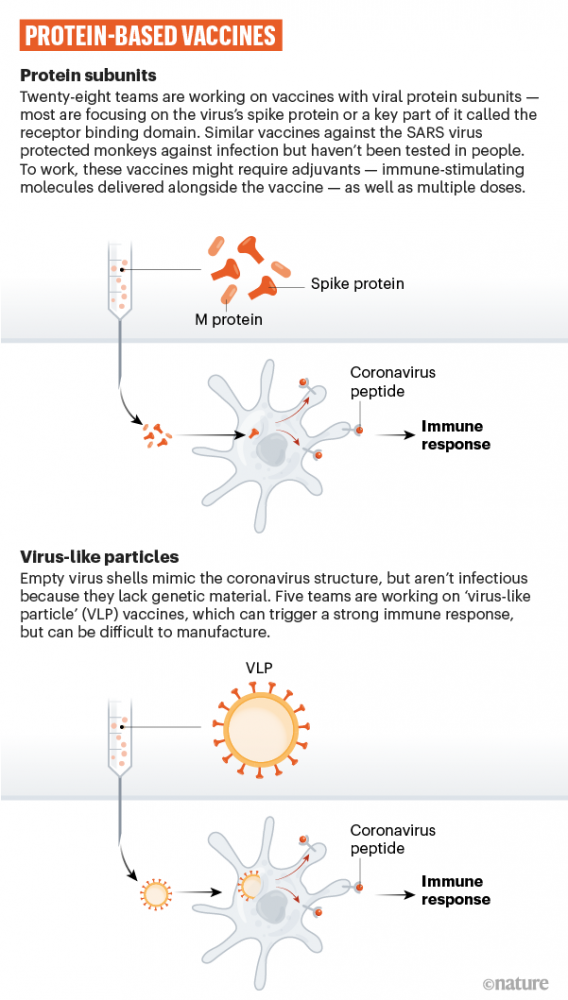
- Totimpfstoffe: Impfstoffe mit abgetöteten Erregern oder Erregerbestandteilen gegen Covid-19 sind derzeit inaktivierte Ganzvirus-Impfstoffkandidaten oder rekombinante Protein Subunit-Impfstoffkandidaten in weit fortgeschrittener klinischer Entwicklung. Erstere sind seit Jahrzehnten bewährt. Um sie herzustellen, werden infektiöse Viren in Zellkulturen produziert, gereinigt und mit Hilfe von physikalischen oder chemischen Prozessen abgetötet. Damit sind sie anschließend nicht mehr infektiös.
Im Unterschied dazu enthalten rekombinante Protein Subunit-Impfstoffe keine vollständigen abgetöteten Erreger mehr, sondern nur kleine Teile davon. Bei den Covid-19-Impfstoffkandidaten wird die DNA mit dem Bauplan für das Spike-Protein z.B. in Baculoviren-DNA eingebracht. In weiterer Folge transportieren modifizierte Baculoviren die neue DNA-Sequenz in Wirtszellen, die dann große Mengen des Antigens herstellen. Für den finalen Impfstoff werden diese gereinigt und mit einem Adjuvans (Wirkverstärker) verbunden.
- Vektorbasierte Impfstoffe: Abgeschwächte Viren als Vehikel. Bei den vektorbasierten Impfstoffen nützt man ein anderes abgeschwächtes Virus dazu, einen harmlosen Teil der Erbinformation von SARS-CoV-2 in einige wenige Körperzellen zu transportieren. Es gibt zwei Arten von Vektoren: vermehrungsfähige (replizierende rekombinante Virus-Vektoren) und nicht vermehrungsfähige (nicht replizierende rekombinante Virus-Vektoren). Im ersten Fall werden Masernviren als Transportmittel verwendet, im zweiten Fall Adenoviren. Beiden ist gemeinsam, dass der Körper nach dem Einbringen der Erbinformation von SARS-CoV-2 das Antigen selbst herstellen muss, was in weiterer Folge eine Immunreaktion des Körpers hervorruft.
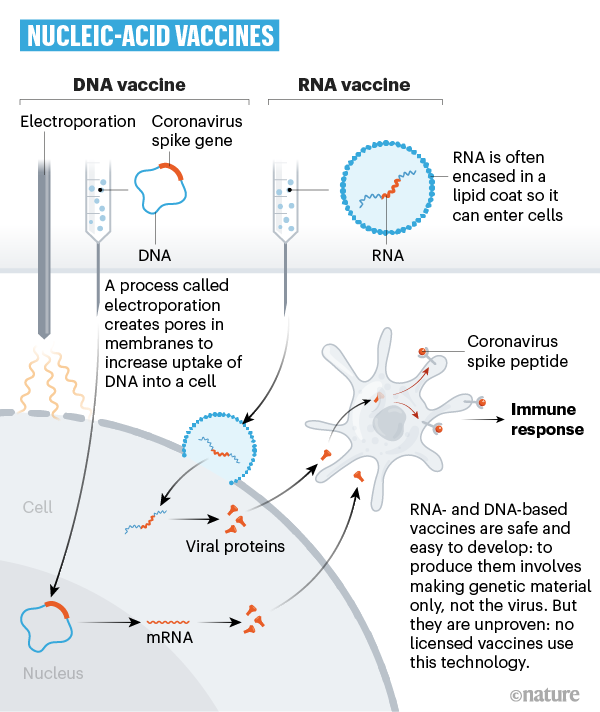
- mRNA-Impfstoffe: Einschleusung von Bauplänen für Virusprotein. Vergleichsweise neu ist die mRNA-Technologie. Allein der Begriff führt leider immer wieder zu Missverständnissen und irrtümlichen Annahmen. Fest steht: Auch diese Technologie greift in das Erbgut des Menschen nicht ein. Der Zellkern, in dem sich die DNA befindet, bleibt völlig unverändert. Außerdem entstehen durch diese Impfstoffe keine vermehrungsfähigen Viren, sondern nur ungefährliche Bestandteile von SARS-CoV-2. Im Vergleich zu den anderen Impfstoffarten setzt diese Technologie schon eine Stufe früher an, denn die in den Impfstoffen enthaltene mRNA enthält nur den Bauplan für ein Virusprotein von SARS-CoV-2. Sie wird mit Hilfe von Lipid-Nanopartikeln in die Zellen transportiert. Dort wird die mRNA als eine Art Blaupause verwendet, um das Virusprotein für begrenzte Zeit selbst herzustellen. Daraufhin kommt es wie bei allen anderen Impfstoffarten zu einer Immunreaktion des Körpers gegen dieses Virusprotein und dem Aufbau des Immunschutzes.
Welche Hersteller haben Covid19-Impfstoff-Kandidaten ins Rennen geschickt?
Nach den Partnern BioNTech und Pfizer sowie dem US-Konzern Moderna meldete am Montag AstraZeneca aus Großbritannien einen entscheidenden Erfolg bei der Impfstoff-Entwicklung. Es folgt eine Auswahl der Impfstoff-Kandidaten in der späten klinischen Entwicklung:
BIONTECH/PFIZER - Die beiden Partner präsentierten als weltweit erste Entwickler positive Wirksamkeitsdaten aus einer Studie der finalen Phase. Demnach war das Risiko, an Covid-19 zu erkranken, für Studienteilnehmer, die den Impfstoff erhielten, um 95 Prozent geringer als ohne Impfung. Inzwischen haben die Unternehmen bei der FDA eine Notfallzulassung für den Impfstoff beantragt. Bei grünem Licht könnten ab Mitte oder Ende Dezember Impfungen in den USA beginnen. Auch bei der EMA sind Unterlagen eingereicht worden. Die Zulassungsstudie mit dem Impfstoff BNT162b2 hatte Ende Juli begonnen. Sie umfasst bis zu 44.000 Teilnehmer. Der Impfstoff basiert auf einem neuen Ansatz, der sogenannten Boten-RNA (mRNA). Ein solcher Impfstoff soll schneller in großem Maßstab hergestellt werden können als herkömmliche, er benötigt aber auch eine höhere Kühlung, was die Logistik erschwert.
MODERNA - Als zweites Unternehmen veröffentlichte der US-Konzern Moderna Mitte November positive Zwischenergebnisse seiner zulassungsrelevanten Studie. Demnach zeigt der Impfstoff, der ebenfalls auf dem mRNA-Ansatz basiert, eine Wirksamkeit von 94,5 Prozent beim Schutz vor Covid-19. Moderna erwartet, in den kommenden Wochen in den USA eine Notfallgenehmigung beantragen zu können. Die Europäische Arzneimittelagentur leitete einen beschleunigten Zulassungsprozess für den Impfstoff ein. Die US-Regierung unterstützt das Projekt mit nahezu einer Milliarde Dollar. Der Biotechkonzern hatte als erstes Unternehmen Mitte März eine klinische Studie der Phase I mit einem Corona-Impfstoff gestartet. Ende Juli begann die entscheidende Wirksamkeitsstudie der Phase III mit 30.000 Teilnehmern.
ASTRAZENECA - Auch der britische Pharmakonzern veröffentlichte nun Studienergebnisse zu seinem Impfstoff-Kandidaten, den er zusammen mit der Universität Oxford entwickelt. Die Zwischenanalyse ergab, dass der Impfstoff eine Wirksamkeit von 90 Prozent zeigt, wenn zunächst eine halbe Dosis verabreicht wurde, gefolgt von einer vollen Dosis mindestens einen Monat später. Gespräche mit der FDA sollen noch diese Woche beginnen, auch mit den Behörden in Großbritannien und Europa sind die Entwickler im Kontakt. Das Vakzin von AstraZeneca beruht auf einer herkömmlichen Herstellungsweise und ist ein sogenannter Vektorimpfstoff, der auf Adenoviren von Affen basiert. Er kann bei Kühlschranktemperatur gelagert werden.
CUREVAC - Der Tübinger Impfstoffentwickler hat im Juni mit der klinischen Erprobung seines Kandidaten begonnen. In der Phase-I-Studie, an der mehr als 250 Probanden teilnahmen, wurde der Impfstoff von CureVac in verschiedenen Dosierungen getestet. Er zeigte eine gute Verträglichkeit und eine ausgewogene Immunantwort. Noch vor Jahresende soll nun die entscheidende Wirksamkeitsstudie mit weltweit bis zu 30.000 Probanden starten. Der Bund unterstützt das Projekt mit bis zu 252 Millionen Euro, im Sommer war er mit 300 Millionen Euro bei CureVac eingestiegen. CureVac-Haupteigner und SAP-Mitgründer Dietmar Hopp rechnet mit einer Zulassung im Frühjahr oder Sommer 2021, in eingeschränkter Form möglicherweise aber auch schon früher.
JOHNSON & JOHNSON - Der US-Pharmakonzern hat die Phase-3-Wirksamkeitsstudie, an der rund 60.000 Menschen teilnehmen sollen, Ende September gestartet. Ergebnisse sollten bis Ende dieses, Anfang kommenden Jahres vorliegen. J&J musste seine zulassungsrelevante Studie wegen einer unerklärten Erkrankung bei einem Probanden unterbrechen. Im Oktober fuhr die Untersuchung wieder hoch, nachdem ein Kontrollgremium grünes Licht dafür gegeben hatte.
SINOVAC - Der Impfstoff CoronaVac des chinesischen Biotechunternehmens befindet sich als einer von einer Handvoll chinesischen Impfstoffkandidaten in der klinischen Phase III. Tests mit Tausenden Freiwilligen laufen in Indonesien, der Türkei und in Brasilien, einem der am stärksten von der Pandemie betroffenen Länder. Studiendaten werden im November erwartet. Anfang Oktober hatte der Gouverneur des brasilianischen Bundesstaates Sao Paulo die heimische Gesundheitsbehörde Anvisa um eine Zulassung des Sinovacs-Impfstoffs gebeten. Er gehört zu jenen Impfstoffen, die im Notfall-Programm der chinesischen Regierung bereits Zehntausenden Menschen vor Abschluss der klinischen Studien verabreicht wurden.
SINOPHARM - Der staatliche chinesische Biotechkonzern testet zwei verschiedene Impfstoffprojekte in Phase-III-Studien. Mitte Juli begann ein breit angelegter Test in den Vereinigten Arabischen Emiraten mit 15.000 Freiwilligen. Auch Argentinien, Peru, Marokko und Bahrain haben Phase-III-Tests mit dem Sinopharm-Kandidaten zugelassen. Das Wall Street Journal hatte berichtet, Sinopharm biete seine Impfstoffe kostenlos chinesischen Studenten an, die für ihr Studium ins Ausland gehen. Mit dem Impfstoff seien bereits rund 480.000 Personen geimpft worden, weitere rund 93.000 hätten die Impfung beantragt.
GAMALEYA-INSTITUT - Das russische Gesundheitsministerium hat den Impfstoff, der im Ausland unter dem Namen „Sputnik V“ auf den Markt gebracht werden soll, am 11. August freigegeben - noch bevor die Ergebnisse der Phase III-Studien vorlagen. In zwei kleineren Tests im Juni und Juli haben dem Fachmagazin „The Lancet“ zufolge alle 76 Teilnehmer Antikörper entwickelt und keine schweren Nebenwirkungen gezeigt. Inzwischen läuft eine große Studie, die 40.000 Teilnehmer umfassen soll. Zwischenergebnissen zufolge zeigte der Impfstoff eine Wirksamkeit von 92 Prozent gegen Covid-19.
Weiterlesen:
Überblicksartikel Impfungen von Florian Krammer („Nature” 2020)
Artikel zu Immunität („The Lancet“ 2020)
Österreichische COVID-19- Impfstrategie
Impfstoffstrategie der EU
Übersicht mRNA Impfstoffentwicklung (2019)
Analyse der Pfizer Studie („Nature“, 9. Nov 2020)
Status Quo Impfstoff-Kandidaten und therapien (PHARMIG, Nov 2020)
Impfungen: altbewährtes und neue Optionen von Dr. Herwig Kollaritsch, Wien (Nov 2020)
%EF%B9%96itok=Gq1_EAAX.jpg)